En diciembre de 2016 Paul Marik publica en CHEST un estudio retrospectivo (Before-After). El grupo control (Before) está constitudio por 47 pacientes con sepsis que recibieron tratamiento estándar en los 7 meses previos al inicio del estudio y en el grupo intervención (After) se incluye a 47 pacientes a los que trata con un "cocktail" de vitamina C, tiamina y corticoides.
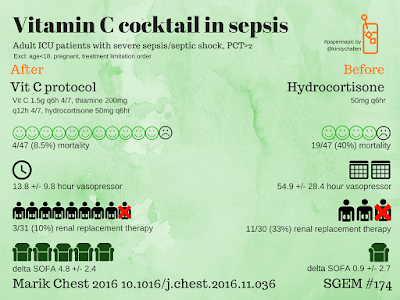
Los resultados son cuanto menos, "impresionantes". En los pacientes tratados con vitamina C la mortalidad fue del 8% Vs 40% de aquellos tratados de forma estándar. Además observó una disminución de: requerimientos de vasopresores (13,8 +/- 9,8 horas Vs 54,9 +/- 28,4 horas), la necesidad de terapias de reemplazo renal (10% Vs 33%) y delta SOFA (4,8 +/- 2,4 Vs 0,9 +/- 2,7).
 |
El protocolo usado en los pacientes es el siguiente:
Cocktail de Marik para la sepsis
|
Vitamina C 1,5 g IV cada 6 horas x 4 días
|
Hidrocortisona 50 mg IV cada 6 horas x
7 días y luego disminuir gradualmente
|
Tiamina 200 mg IV cada 12 horas x 4
días o hasta el alta de UCI
|
Fisiopatología del Cocktail:
Se conoce desde hace muchos años que la vitamina C es un poderoso antioxidante con efectos beneficiosos sobre el sistema inmune, pero además de esto en los últimos años se han ido conociendo nuevas funciones de esta. En una charla de Critical Care Reviews Marik argumenta:
- La vitamina C además de antioxidante es coenzima de múltiples reacciones importantes y se agota rapidamente en estados de alto estrés metabólico como la sepsis
- Los humanos no podemos sintetizar la vitamina C, con lo cual solo podemos obtenerla de fuentes exógenas
- El transportador de la vitamina C en el tracto gastrointestinal se satura con dosis de 500 mg/día, con lo cual si se quieren administrar dosis más altas se debe hacer por vía parenteral
- Las glándulas suprarrenales requieren de Vit C para la producción de catecolaminas y cortisol, además es necesaria para la activación del receptor adrenérgico, por lo que en la sepsis parte del fracaso hemodinámico puede ser explicado por alteraciones metabólicas
- Existe una relación de sinergismo entre la Vit C y los glucocorticoides. En sepsis ocurre oxidación de los receptores de glucocorticoides. La Vit C es capaz de restituir la función de estos receptores
- La tiamina es otra vitamina que merma en la sepsis, restituirla ha demostrado disminuir la mortalidad en estos pacientes. Además las dosis elevadas de vitamina C en pacientes con déficit de tiamina puede llevar a la producción de litiasis renal por cristales de oxalato, por lo que al administrar tiamina se disminuye el riesgo de este efecto adverso.
El estudio de Marik está inspirado en varios trabajos en los que se ha usado de la vitamina C en pacientes críticos:
- En 2000 Tanaka demostró que dosis de vitamina C de 66 mg/kg/h durante 24 horas en pacientes quemados, disminuía el volumen de líquidos necesarios para le resucitación y también la aparición de edemas, además de mejorar la diuresis y la oxigenación.
- En 2002 Nathens suplementó a enfermos críticos quirúrgicos con vitamina E y 1000 mg de vitamina C cada 8 horas hasta el alta para observar la disminución de complicaciones respiratorias. Encontró menos complicaciones aunque sin significación estadística por bajo número de complicaciones en general.
- En 2014 Fowler demuestra que dosis elevadas de vitamina C (50 mg/kg IV cada 6 horas) son seguras en pacientes sépticos, además de mejorar el delta SOFA y los marcadores inflamatorios
- En 2016 Zabeth estudia el efecto de altas dosis de vitamina C (25 mg/kg IV cada 6 horas) en el requerimiento de vasopresores de pacientes con shock séptico, obteniendo una disminución significativa de vasopresores y además disminución en la mortalidad en los tratados con vitamina C
Ante estos resultados nos planteamos una pregunta:
¿Es posible que en algo tan simple como la vitamina C se esconda una potente arma para disminuir de forma importante la mortalidad causada por la sepsis?
Mi opinión personal:
Es posible, pero debemos ser cautos. Aunque el estudio viene de la mano de alguien como Paul Marik, no debemos olvidar que:
- Es un solo trabajo
- Son sólo 94 pacientes
- Es retrospectivo
- Demuestra asociación y no causalidad
- No hubo aleatorización
- No hubo ciego
Los resultados han generado mucho revuelo en la comunidad científica. Gran cantidad de opiniones a favor y en contra pueden ser encontradas en la web y en las redes sociales, en parte probablemente porque el primer firmante es Paul Marik. Lo cierto es que en su hospital (Sentara Norfolk General Hospital en Virginia USA) actualmente el cocktail se inicia en la urgencia junto con los antibióticos en los pacientes sépticos. Además han tratado ya a más 150 pacientes y refiere que de los pocos fallecidos ninguno lo ha hecho de fracaso multiorgánico. Otros hospitales de Virginia están usando el protocolo al considerar que siendo la terapia relativamente inocua y en vista de los resultados expuestos el beneficio supera ampliamente los riesgos.
Es evidente que se requiere de ensayos clínicos controlados que validen estos resultados, antes de generar cualquier cambio sustancial en el tratamiento habitual de la sepsis. Debemos recordar a Linus Pauling, (químico ganador del premio Nobel de química en 1954 por sus trabajos sobre los enlaces moleculares), quien tras ser tratado por trastornos renales con dosis altas de vitaminas inició una cruzada a favor la megavitaminosis en la década de 1970 llegando a publicar junto con el cirujano Ewan Cameron 2 estudios en los cuales aseguraban que los pacientes con cáncer en estadio terminal aumentaban su expectativa de vida al tomar dosis elevadas de vitamina C. Estos resultados han sido rebatidos en gran cantidad de estudios realizados posteriormente.
El tiempo y la medicina basada en la evidencia determinarán el futuro de la vitamina C en el tratamiento de la sepsis. Es hora de intentar replicar los resultados del equipo de Marik de manera controlada y aleatorizada.
Mi parte racional me dice: "no es posible que algo tan simple como el zumo de naranja intravenoso sea la respuesta a un problema tan complejo como la sepsis".
Mi parte emocional responde: "La navaja de Ockham dice que no solo es posible sino también es lo más probable".
Jesús Manuel Nieves Alonso






