Este años pretendemos que el curso tenga sentido del humor . Que además de aprender ,el tiempo que paséis en él , sea agradable .
Durante dos meses hemos estado haciendo entradas en este blog sobre temas relacionados con el curso .
En esta última entrada antes del curso queremos que sonrías , y a la vez pienses ... como pretendemos en el curso .
CMP 2014

miércoles, 15 de febrero de 2012
martes, 14 de febrero de 2012
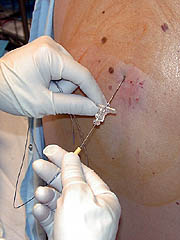
INDUCCION E INTUBACION DE SECUENCIA RAPIDA:¿QUIEN LO HACE BIEN?
Entrada realizada por Fº Gabriel Barrios Aranda
 Si a cualquier persona relacionada o no con la medicina, la pidiésemos que describiese la foto de un anestesista trabajando, probablemente vería un médico con un laringoscopio en una mano y un tubo endotraqueal en la otra accediendo a la vía aérea del paciente. Tal vez haya otros igual o más importantes, pero probablemente éste sea el acto que más define a todos los profesionales de la anestesia.
Si a cualquier persona relacionada o no con la medicina, la pidiésemos que describiese la foto de un anestesista trabajando, probablemente vería un médico con un laringoscopio en una mano y un tubo endotraqueal en la otra accediendo a la vía aérea del paciente. Tal vez haya otros igual o más importantes, pero probablemente éste sea el acto que más define a todos los profesionales de la anestesia.
Si en lugar de una foto visionásemos una película de los diferentes quirófanos, de uno o varios hospitales, y realizada por pequeños capítulos que recogiesen solamente el momento de la inducción e intubación, veríamos diferentes matices en una escena repetida; matices con la colocación y ventilación del paciente; con los fármacos, dosis y momento de administrarlos.
La inducción e intubación de secuencia rápida (en adelante IISR) es una técnica implantada para facilitar la intubación traqueal rápida e intentar reducir lo más posible el riesgo de aspiración en pacientes definidos como “estómago lleno”. Está definida por el hipnótico y el relajante muscular, incorporándose posteriormente el analgésico gracias a la aparición de opiáceos de vida media corta o ultracorta. Se han añadido otros actos o técnicas junto con los fármacos. Hagamos un breve repaso de los fármacos y técnicas utilizadas en la IISR :
Posición del paciente: Según las posibilidades de regurgitación e hipotensión algunos defienden la posición semisentado, otros con la cabeza en plano superior al cuerpo, en plano inferior, en decúbito supino o en posición en “V”.
Presión cricoidea ( Maniobra de Sellick): Hay anestesistas que la consideran efectivas y otros no por la no garantía de no reflujo, la dificultad para dar una presión adecuada, el momento de ejecutar la maniobra y la mala visualización de la glotis por desplazamiento de ésta.
Ventilación con mascarilla: Evitando la ventilación con presión positiva antes de la intubación reducimos la insuflación gástrica y probabilidad de regurgitación y aspiración. Sin embargo hay anestesistas que lo consideran aceptable si no se sobrepasa una presión de veinte centímetros de agua (apertura del esfínter esofágico inferior). Además hay situaciones en las que es necesario o recomendable realizarla (obesidad, paciente crítico, emergencia).
Hipnóticos: La ketamina es útil en pacientes con inestabilidad hemodinámica pero puede ser peligroso en enfermos con patología cardiovascular o traumatismo craneoencefálico. El midazolam a dosis elevadas se puede usar para la inducción pero tiene inicio lento. El tiopental produce hipnosis rápida pero efectos hemodinámicos severos. El etomidato es muy estable hemodinámicamente pero puede desencadenar actividad epileptiforme tipo mioclonías, y cierto grado de insuficiencia suprarrenal peligroso en pacientes sépticos. El propofol es la droga preferida por los anestesistas, pero cuando la hipotensión arterial es un problema puede agravar la situación del paciente.
Relajantes neuromusculares: La succinilcolina tiene un inicio de acción muy rápido pero múltiples efectos secundarios, y es peligroso en pacientes con hiperpotasemia (quemados, insuficiencia renal, politraumatismos), antecedentes de hipertermia maligna e hipertensión craneal. Se puede realizar una“precurarización” para evitar sus efectos secundarios pero puede provocar dificultad respiratoria en el paciente despierto.Los relajantes neuromusculares no despolarizantes se usaban en la IISR solo cuando la succinilcolina estaba contraindicada debido a su larga duración. Además, tanto el rocuronio como el vecuronio pueden prolongar su vida media en pacientes con insuficiencia renal o hepática. Con la aparición del sugammadex como reversor del bloqueo neuromuscular se ha subsanado este problema, y se ha generalizado el uso del rocuronio en la IISR. Sin embargo, no podemos volver a utilizarlo salvo a dosis muy elevadas, si fracasásemos en la IISR y fuese necesario despertarlo y volver a utilizarlo.
La práctica del “timing” y el “priming” hace acortar los tiempos de inducción e intubación pero también tiene defensores y detractores por sus posibles complicaciones: La relajación sin hipnosis en el primer caso y la dificultad respiratoria en paciente despierto en el segundo.
Opioides: Debido al inicio de acción rápida del fentanilo y remifentanilo su uso se ha generalizado antes de los hipnóticos, dando mayor estabilidad hemodinámica a la intubación orotraqueal. Existe la posibilidad de fallo respiratorio en caso de no poder intubar, y riesgo de rigidez torácica o cierre de cuerdas vocales si el paciente no está bien relajado. Además atraviesa la barrera úteroplacentaria.
¿Qué hay que hacer?
Hay que elegir el fármaco en función de la situación del paciente y el escenario en que nos encontremos, evitando la infra y sobredosis y valorando el bienestar del paciente con el priming y timing. La ventilación manual con mascarilla es recomendable en algunos pacientes, y la presión cricoidea así como la posición del paciente son muy controvertidas.
¿Por qué no estamos de acuerdo? La respuesta probablemente es que no hay suficientes estudios ni consenso para establecer un protocolo de IISR. Mientras tanto, habrá que guiarse por los estudios disponibles, la experiencia personal y una valoración de la situación de forma global.
Por otro lado, hay anestesistas que………
lunes, 13 de febrero de 2012
OBJETIVO: VALORAR LA ENDOTOXINEMIA
La endotoxina juega un papel primordial en la patogénesis de la sepsis al producir citocinas proinflamatorias, como el TNF-α y la IL-1, que actúan como mediadores de la respuesta inflamatoria y de la lesión tisular, al activar la cascada de la coagulación y estimular factores del complemento. Por este motivo, la endotoxina se considera uno de los principales desencadenantes del shock séptico.
La endotoxina es un componente de la membrana externa de las bacterias gram negativas. Es una molécula compleja que cuenta con tres componentes, un glucofosfolípido llamado lípido A (considerado como la parte activa del complejo), una estructura central de azúcares, etanolamida y fosfato (transportador) y un antígeno 0, que es una larga cadena de azúcares específicos de especie (transportador).
A dosis pequeñas, la endotoxina produce fiebre, activación del complemento C5a, C3b, predisposición a fagocitosis, estímulo de producción y activación de fagolisosomas macrofágicos y favorece la producción de anticuerpos en los linfocitos B. A dosis altas, origina hipotensión mediada por interleucinas, shock distributivo y coagulación intravascular diseminada.
Romaschin, empleando técnicas de quimioluminiscencia, clasificó la actividad de endotoxina (EA) en baja (<0,4), intermedia (>0,4 pero <0,6) y alta (>0,6). Varios estudios han demostrado que niveles altos de EA están relacionados con un incremento de la morbimortalidad. Por tanto, el empleo de un test diagnóstico que mida la endotoxinemia de forma precoz puede ser una herramienta tremendamente útil para ayudarnos con el diagnóstico y el tratamiento inicial de aquellos pacientes que pueden estar sufriendo sepsis.
Si tuviéramos que recordar de este resumen tan sólo un dato, este podría ser que una actividad de endotoxina en sangre por encima de 0,6 puede indicar mal pronóstico.
Bibliografía
Novelli G, Ferretti G, Poli L, Pretagostini R, Ruberto F, Perrella SM, et al. Clinical results of treatment of postsurgical endotoxin-mediated sepsis with polymyxin-B direct hemoperfusion.Transplact Proc 2010;42:1021-4.
Candel FJ et al. La depuración de endotoxina como tratamiento coadyuvante en la sepsis grave por microorganismos gramnegativos. Rev Esp Quimioter 2010;23(3):115-121.
Opal SM. Endotoxins and other sepsis triggers. En: Ronco C, Piccinni P, Rosner MH. Endotoxemia and endotoxin shock. Basel: Karger; 2010. p. 14-24.
viernes, 10 de febrero de 2012
Moderadores del Curso de Medicina Perioperatoria
Como ya hemos comentado en anteriores entradas , los moderadores tiene una singular importancia en este curso .
Las charlas no serán demasiado largas . La intención es que sean una exposición de las opiniones personales y del state of art , de los ponentes y de los temas que se traten .
Luego en el debate /coloquio con los moderadores deberían aparecer las dudas / polémicas que nos preocupan en el día a día .
Esa es su misión , mediante un dialogo fluido , en el que vuestra participación es esencial , ya que los moderadores intentarán fomentar vuestras intervenciones .
Ahora os presentamos brevemente a los moderadores del curso 2012 .
Javier Belda , es sobradamente conocido por la mayoría de vosotros . Actualmente es jefe de servicio del Hospital clínico Universitario de Valencia , y sin duda es el anestesiólogo que más ha hecho por promocionar y extender el conocimiento sobre la ventilación mecánica y la patología respiratoria grave en nuestro pais .
Desde hace 18 años dirige un curso de Ventilación Mecánica en Valencia ( esta año se celebrará del 7 al 9 de Marzo ) , de cuyo éxito da fé la dificultad para conseguir plaza .
Tiene numerosas publicaciones nacionales e internacionales en su faceta investigadora ( más de 100 publicaciones de diverso tipo ) , pertenece a varios comités de la sociedad Europea de Anestesia y de otras de prestigio internacional , y es Doctor en Medicina .
Su servicio es muy conocido por su labor en anestesia , su investigación en ventilación mecánica , y por su reanimación / cuidados intensivos quirúrgicos .
También realiza una labor docente universitaria y ha trabajado en la dirección médica y en labores organizativas , siempre en instituciones sanitarias . Ha completado su formación con stages en diversos momentos de su vida en Italia y en Estados Unidos . En fin un hombre polifacético que como siempre estimulará el debate y la conversación . Es un fan acérrimo de los Beatles , quizá no sepáis reconocerle en esta foto .
 Manuel Luis Avellanas Chavala es médico adjunto del Servicio de Medicina Intensiva del Hospital San Jorge de Huesca y sin duda uno de los más importantes especialista en medicina de altura de nuestro país .Manolo tiene numerosas publicaciones y libros sobre el tema producto de sus expediciones y ascensiones como montañero y como investigador . Por todo ello se le otorgó el premio Aragonés del año en Investigación el año 2007 .Entre sus ascensiones destacan dos ochomiles , el mítico K2 , y el Nanga Parbat . Y entre sus publicaciones los libros sobre Medicina crítica en medios hostiles y aislados , y sobre mediicna de montaña . Será muy interesante su aportación , junto a la de Michael Grocott para conocer las aplicaciones de esta medicina de la altitud a nuestro día a día . Su dilatada experiencia en este campo será una oportuna aportación a su mesa .
Manuel Luis Avellanas Chavala es médico adjunto del Servicio de Medicina Intensiva del Hospital San Jorge de Huesca y sin duda uno de los más importantes especialista en medicina de altura de nuestro país .Manolo tiene numerosas publicaciones y libros sobre el tema producto de sus expediciones y ascensiones como montañero y como investigador . Por todo ello se le otorgó el premio Aragonés del año en Investigación el año 2007 .Entre sus ascensiones destacan dos ochomiles , el mítico K2 , y el Nanga Parbat . Y entre sus publicaciones los libros sobre Medicina crítica en medios hostiles y aislados , y sobre mediicna de montaña . Será muy interesante su aportación , junto a la de Michael Grocott para conocer las aplicaciones de esta medicina de la altitud a nuestro día a día . Su dilatada experiencia en este campo será una oportuna aportación a su mesa .
 Rafael Gonzalez es medico adjunto de anestesia y reanimación del Hospital Universitario de León . Los últimos 10 años ha trabajado en la Unidad de Reanimación / Cuidados intensivos quirúrgicos de ese hospital , colaborando a su fundación .Ha sido tutor de residentes y miembro de las comisiones de docencia e infecciones de su hospital .Es miembro activo deL Grupos de trabajo para Infecciones perioperatorias , y de la Sección de Cuidados Intensivos de la SEDAR Su entusiasmo contagioso , y su pasión y conocimiento por los temas a tratar , son un aval para ser moderador en el presente formato del curso .
Rafael Gonzalez es medico adjunto de anestesia y reanimación del Hospital Universitario de León . Los últimos 10 años ha trabajado en la Unidad de Reanimación / Cuidados intensivos quirúrgicos de ese hospital , colaborando a su fundación .Ha sido tutor de residentes y miembro de las comisiones de docencia e infecciones de su hospital .Es miembro activo deL Grupos de trabajo para Infecciones perioperatorias , y de la Sección de Cuidados Intensivos de la SEDAR Su entusiasmo contagioso , y su pasión y conocimiento por los temas a tratar , son un aval para ser moderador en el presente formato del curso .
 Gerardo Aguilar es Doctor en Medicina y miembro del Servicio de Anestesia y Reanimación del Hospital Universitario de Valencia . A pesar de su juventud tiene numerosas publicaciones nacionales e internacionales .También ha participado como investigador colaborador y como investigador principal en numerosos ensayos clínicos en anestesia y cuidados intensivos . Su interés ha estado ligado a la ventilación mecánica y especialmente en los últimos años al mundo de la infección en los pacientes críticos , desarrollando en la actualidad estudios sobre la farmacocinética de los antibióticos , y sobre el tratamiento antivírico en los pacientes con sepsis grave . Gerardo destaca por su seriedad y meticulosidad ( y buen humos ) , que le hacen ser un gran conocedor de los temas atratar en nuestro curso .
Gerardo Aguilar es Doctor en Medicina y miembro del Servicio de Anestesia y Reanimación del Hospital Universitario de Valencia . A pesar de su juventud tiene numerosas publicaciones nacionales e internacionales .También ha participado como investigador colaborador y como investigador principal en numerosos ensayos clínicos en anestesia y cuidados intensivos . Su interés ha estado ligado a la ventilación mecánica y especialmente en los últimos años al mundo de la infección en los pacientes críticos , desarrollando en la actualidad estudios sobre la farmacocinética de los antibióticos , y sobre el tratamiento antivírico en los pacientes con sepsis grave . Gerardo destaca por su seriedad y meticulosidad ( y buen humos ) , que le hacen ser un gran conocedor de los temas atratar en nuestro curso .
Amparo Benedicto Buendía es cardióloga en el H.U. de La Princesa . Actualmente reparte su labor diaria entre la sala de hemodinámica y la unidad coronaria . Amparo es tutora de residentes de cardiología , lo que es un aval de cara a ser una docente estupenda con otros especialistas . Siempre se ha destacado por creer en la colaboración multidisciplinar y ha facilitado ( tanto ella como todo su servicio ) el aprendizaje en sus unidades ( laboratorio de ecocardiografía y unidad coronaria ) a médicos de otras especialidades .Como buena cardiologa hemodinamista y médico de la coronaria participa en una larga lista de ensayos clínicos relacinados con los stents , la antiagragacioón y los betabloqueantes . Su participación nos aportará una visión desde otro plano de los problemas realcionados con su mesa .
 Ricardo Navarro Suay pertenece al Servicio de Anestesia del H.U "La Princesa" (Madrid) con la categoría de médico residente de cuarto año . Ricardo es Capitán Médico con capacitación de médico de vuelo y aeroevacuaciones sanitarias, de medicina hiperbárica y tratamiento de accidentes de buceo y de asistencia sanitaria en ambiente nuclear, biológico y químico. Ha participado como médico militar en los últimos 10 años en despliegues internacionales en el Océano Índico, Bosnia-Hercegovina, Haití, Líbano y Afganistán (en algunos de ellos en varias ocasiones), estando en los conflictos bélicos en primera línea . Es Doctor en Medicina por la Universidad Autónoma de Madrid. A pesar de su juventud tiene numerosas publicaciones sobre anestesiología y medicina militar. Recientemente ha colaborado en la redacción de un protocolo de hemorragia masiva en el ámbito del ejercito español .
Ricardo Navarro Suay pertenece al Servicio de Anestesia del H.U "La Princesa" (Madrid) con la categoría de médico residente de cuarto año . Ricardo es Capitán Médico con capacitación de médico de vuelo y aeroevacuaciones sanitarias, de medicina hiperbárica y tratamiento de accidentes de buceo y de asistencia sanitaria en ambiente nuclear, biológico y químico. Ha participado como médico militar en los últimos 10 años en despliegues internacionales en el Océano Índico, Bosnia-Hercegovina, Haití, Líbano y Afganistán (en algunos de ellos en varias ocasiones), estando en los conflictos bélicos en primera línea . Es Doctor en Medicina por la Universidad Autónoma de Madrid. A pesar de su juventud tiene numerosas publicaciones sobre anestesiología y medicina militar. Recientemente ha colaborado en la redacción de un protocolo de hemorragia masiva en el ámbito del ejercito español .

Luis Quecedo es Doctor en Medicina , especialista en Medicina Interna y en Anestesiología y Reanimación , y actualmente pertenece al Servicio de Anestesia y Reanimación del Hospital de la Princesa . Casi toda su carrera profesional en el mundo de la anestesia ha estado ligada a los cuidados intensivos . Sus principales áreas de interés han sido la nutrición artificial , la monitorización , el dolor postoperatorio , y especialmente la infección en el paciente grave . También es Master en Gestión Clínica de servicios sanitarios y especialista en Medicina Basada en la Evidencia . La suma de sus conocimientos será especialmente útil en el debate de su mesa .
 Marian Santos Ampuero es Doctora en Medicina , Diplomada en Investigación Clínica por la U.A.B. y especialista en Anestesiología y Reanimación , ejerciendo actualmente su labor en el H.U. La Princesa . Junto a otra de las moderadoras , Mar Orts , su actividad siempre ha estado ligada al mundode la Medicina Transfusional en todas las áreas que ésta comprende : hemorragía masiva , ahorro de sangre , coagulación ... También es experta en seguridad siendo una de las líderes en el H.U. de La Princesa en la implantación del "Check List " para una cirugía más segura . Su visión analítica será una buena aportación a la mesa .
Marian Santos Ampuero es Doctora en Medicina , Diplomada en Investigación Clínica por la U.A.B. y especialista en Anestesiología y Reanimación , ejerciendo actualmente su labor en el H.U. La Princesa . Junto a otra de las moderadoras , Mar Orts , su actividad siempre ha estado ligada al mundode la Medicina Transfusional en todas las áreas que ésta comprende : hemorragía masiva , ahorro de sangre , coagulación ... También es experta en seguridad siendo una de las líderes en el H.U. de La Princesa en la implantación del "Check List " para una cirugía más segura . Su visión analítica será una buena aportación a la mesa .
 Esperanza mata Mena , hizo la residencia en el Hospital Germans Trias i Pujol de Barcelona , y lleva 10 años como anestesióloga en el H.U. de La Princesa . Esperanza es la responsable de los microtalleres del curso , participa en la moderación del sábado por la mañana , y coordina todo lo relativo a la infraestructura y actos del curso . Sus principales campos de acción son la seguridad del paciente , liderando junto a Marian Santos la implantación de la lista del check list para la seguridad del paciente en el Hospital de La princesa , el paciente de riesgo y la anestesia para cirugía mayor no cardica. Ha sido investigadora principal en el estudio POISSE sobre los betabloqueantes perioperatorios en el paciente de riesgo cardiovascular . Esperanza es una organizadora nata , y una persona con muy buen gusto, con lo cual estamos seguros que todo estará bien engrasado para cuando asistáis al curso disfrutéis como nunca.
Esperanza mata Mena , hizo la residencia en el Hospital Germans Trias i Pujol de Barcelona , y lleva 10 años como anestesióloga en el H.U. de La Princesa . Esperanza es la responsable de los microtalleres del curso , participa en la moderación del sábado por la mañana , y coordina todo lo relativo a la infraestructura y actos del curso . Sus principales campos de acción son la seguridad del paciente , liderando junto a Marian Santos la implantación de la lista del check list para la seguridad del paciente en el Hospital de La princesa , el paciente de riesgo y la anestesia para cirugía mayor no cardica. Ha sido investigadora principal en el estudio POISSE sobre los betabloqueantes perioperatorios en el paciente de riesgo cardiovascular . Esperanza es una organizadora nata , y una persona con muy buen gusto, con lo cual estamos seguros que todo estará bien engrasado para cuando asistáis al curso disfrutéis como nunca.
Las charlas no serán demasiado largas . La intención es que sean una exposición de las opiniones personales y del state of art , de los ponentes y de los temas que se traten .
Luego en el debate /coloquio con los moderadores deberían aparecer las dudas / polémicas que nos preocupan en el día a día .
Esa es su misión , mediante un dialogo fluido , en el que vuestra participación es esencial , ya que los moderadores intentarán fomentar vuestras intervenciones .
Ahora os presentamos brevemente a los moderadores del curso 2012 .
Javier Belda , es sobradamente conocido por la mayoría de vosotros . Actualmente es jefe de servicio del Hospital clínico Universitario de Valencia , y sin duda es el anestesiólogo que más ha hecho por promocionar y extender el conocimiento sobre la ventilación mecánica y la patología respiratoria grave en nuestro pais .
Desde hace 18 años dirige un curso de Ventilación Mecánica en Valencia ( esta año se celebrará del 7 al 9 de Marzo ) , de cuyo éxito da fé la dificultad para conseguir plaza .
Tiene numerosas publicaciones nacionales e internacionales en su faceta investigadora ( más de 100 publicaciones de diverso tipo ) , pertenece a varios comités de la sociedad Europea de Anestesia y de otras de prestigio internacional , y es Doctor en Medicina .
Su servicio es muy conocido por su labor en anestesia , su investigación en ventilación mecánica , y por su reanimación / cuidados intensivos quirúrgicos .
También realiza una labor docente universitaria y ha trabajado en la dirección médica y en labores organizativas , siempre en instituciones sanitarias . Ha completado su formación con stages en diversos momentos de su vida en Italia y en Estados Unidos . En fin un hombre polifacético que como siempre estimulará el debate y la conversación . Es un fan acérrimo de los Beatles , quizá no sepáis reconocerle en esta foto .
 Manuel Luis Avellanas Chavala es médico adjunto del Servicio de Medicina Intensiva del Hospital San Jorge de Huesca y sin duda uno de los más importantes especialista en medicina de altura de nuestro país .Manolo tiene numerosas publicaciones y libros sobre el tema producto de sus expediciones y ascensiones como montañero y como investigador . Por todo ello se le otorgó el premio Aragonés del año en Investigación el año 2007 .Entre sus ascensiones destacan dos ochomiles , el mítico K2 , y el Nanga Parbat . Y entre sus publicaciones los libros sobre Medicina crítica en medios hostiles y aislados , y sobre mediicna de montaña . Será muy interesante su aportación , junto a la de Michael Grocott para conocer las aplicaciones de esta medicina de la altitud a nuestro día a día . Su dilatada experiencia en este campo será una oportuna aportación a su mesa .
Manuel Luis Avellanas Chavala es médico adjunto del Servicio de Medicina Intensiva del Hospital San Jorge de Huesca y sin duda uno de los más importantes especialista en medicina de altura de nuestro país .Manolo tiene numerosas publicaciones y libros sobre el tema producto de sus expediciones y ascensiones como montañero y como investigador . Por todo ello se le otorgó el premio Aragonés del año en Investigación el año 2007 .Entre sus ascensiones destacan dos ochomiles , el mítico K2 , y el Nanga Parbat . Y entre sus publicaciones los libros sobre Medicina crítica en medios hostiles y aislados , y sobre mediicna de montaña . Será muy interesante su aportación , junto a la de Michael Grocott para conocer las aplicaciones de esta medicina de la altitud a nuestro día a día . Su dilatada experiencia en este campo será una oportuna aportación a su mesa .
.
 Rafael Gonzalez es medico adjunto de anestesia y reanimación del Hospital Universitario de León . Los últimos 10 años ha trabajado en la Unidad de Reanimación / Cuidados intensivos quirúrgicos de ese hospital , colaborando a su fundación .Ha sido tutor de residentes y miembro de las comisiones de docencia e infecciones de su hospital .Es miembro activo deL Grupos de trabajo para Infecciones perioperatorias , y de la Sección de Cuidados Intensivos de la SEDAR Su entusiasmo contagioso , y su pasión y conocimiento por los temas a tratar , son un aval para ser moderador en el presente formato del curso .
Rafael Gonzalez es medico adjunto de anestesia y reanimación del Hospital Universitario de León . Los últimos 10 años ha trabajado en la Unidad de Reanimación / Cuidados intensivos quirúrgicos de ese hospital , colaborando a su fundación .Ha sido tutor de residentes y miembro de las comisiones de docencia e infecciones de su hospital .Es miembro activo deL Grupos de trabajo para Infecciones perioperatorias , y de la Sección de Cuidados Intensivos de la SEDAR Su entusiasmo contagioso , y su pasión y conocimiento por los temas a tratar , son un aval para ser moderador en el presente formato del curso .Amparo Benedicto Buendía es cardióloga en el H.U. de La Princesa . Actualmente reparte su labor diaria entre la sala de hemodinámica y la unidad coronaria . Amparo es tutora de residentes de cardiología , lo que es un aval de cara a ser una docente estupenda con otros especialistas . Siempre se ha destacado por creer en la colaboración multidisciplinar y ha facilitado ( tanto ella como todo su servicio ) el aprendizaje en sus unidades ( laboratorio de ecocardiografía y unidad coronaria ) a médicos de otras especialidades .Como buena cardiologa hemodinamista y médico de la coronaria participa en una larga lista de ensayos clínicos relacinados con los stents , la antiagragacioón y los betabloqueantes . Su participación nos aportará una visión desde otro plano de los problemas realcionados con su mesa .
 Ricardo Navarro Suay pertenece al Servicio de Anestesia del H.U "La Princesa" (Madrid) con la categoría de médico residente de cuarto año . Ricardo es Capitán Médico con capacitación de médico de vuelo y aeroevacuaciones sanitarias, de medicina hiperbárica y tratamiento de accidentes de buceo y de asistencia sanitaria en ambiente nuclear, biológico y químico. Ha participado como médico militar en los últimos 10 años en despliegues internacionales en el Océano Índico, Bosnia-Hercegovina, Haití, Líbano y Afganistán (en algunos de ellos en varias ocasiones), estando en los conflictos bélicos en primera línea . Es Doctor en Medicina por la Universidad Autónoma de Madrid. A pesar de su juventud tiene numerosas publicaciones sobre anestesiología y medicina militar. Recientemente ha colaborado en la redacción de un protocolo de hemorragia masiva en el ámbito del ejercito español .
Ricardo Navarro Suay pertenece al Servicio de Anestesia del H.U "La Princesa" (Madrid) con la categoría de médico residente de cuarto año . Ricardo es Capitán Médico con capacitación de médico de vuelo y aeroevacuaciones sanitarias, de medicina hiperbárica y tratamiento de accidentes de buceo y de asistencia sanitaria en ambiente nuclear, biológico y químico. Ha participado como médico militar en los últimos 10 años en despliegues internacionales en el Océano Índico, Bosnia-Hercegovina, Haití, Líbano y Afganistán (en algunos de ellos en varias ocasiones), estando en los conflictos bélicos en primera línea . Es Doctor en Medicina por la Universidad Autónoma de Madrid. A pesar de su juventud tiene numerosas publicaciones sobre anestesiología y medicina militar. Recientemente ha colaborado en la redacción de un protocolo de hemorragia masiva en el ámbito del ejercito español .
Luis Quecedo es Doctor en Medicina , especialista en Medicina Interna y en Anestesiología y Reanimación , y actualmente pertenece al Servicio de Anestesia y Reanimación del Hospital de la Princesa . Casi toda su carrera profesional en el mundo de la anestesia ha estado ligada a los cuidados intensivos . Sus principales áreas de interés han sido la nutrición artificial , la monitorización , el dolor postoperatorio , y especialmente la infección en el paciente grave . También es Master en Gestión Clínica de servicios sanitarios y especialista en Medicina Basada en la Evidencia . La suma de sus conocimientos será especialmente útil en el debate de su mesa .
Mar Orts Rodriguez es especialista en Anestesiología y Reanimación . Actualmente trabaja en el H.U. de La Princesa en las áreas de Reanimación (cuidados intensivos quirúrgicos ) y en anestesia para cirugía cardiaca . Como hemos comentado antes su actividad profesional ha estado siempre ligada la Medicina Transfusional . Otras áreas de su interés son la monitorización , la hemodinámica , y el perioperatorio de la cirugía cardiovascular .
Recientemente ha liderado junto a otros compañeros el protocolo de Hemorragía masiva del H.U. de la Princesa. La pasión por las cosas en las que se involucra será de especial utilidad en su mesa .jueves, 9 de febrero de 2012
NUEVOS ANTICOAGULANTES
 Entrada realizada por Blanca Aznárez Zango. Servicio Anestesia y Reanimación . H.U. La Princesa
Entrada realizada por Blanca Aznárez Zango. Servicio Anestesia y Reanimación . H.U. La PrincesaEn los últimos años han aparecido en el mercado nuevos fármacos anticoagulantes para la prevención de la enfermedad tromboembólica venosa en el periodo perioperatorio.
Estos presentan ventajas frente a fármacos clásicos como las heparinas y los antagonistas de la vitamina K. Entre estas ventajas se encuentran la administración oral a dosis fijas y no precisar una monitorización de los parámetros de la coagulación.
Teniendo en cuenta su mecanismo de acción se pueden dividir en dos grupos principalmente:
- Inhibidores directos de la trombina: Dabigatran.
- Inhibidores directos del factor Xa: Rivaroxaban y Apixaban.
DABIGATRAN
Es un inhibidor directo de la trombina, de rápido inicio de acción, que no requiere una monitorización de la coagulación de rutina.
Se administra por vía oral en dosis fijas de 220 mg cada 24 horas, siendo la primera dosis de 120 mg. En ancianos y en sujetos con un aclaramiento de creatinina entre 30 y 50 ml/min, la dosis recomendada es de 150 mg cada 24 horas, con una dosis inicial de 75 mg.
Su uso no está recomendado en caso de fallo hepático (aumento de transaminasas mayor a dos veces el valor de referencia) o insuficiencia renal severa (ClCr < 30 ml/min) o tratamiento concomitante con quinidina.
Desde hace varios años su uso está aprobado para la prevención primaria de episodios de tromboembolismo venoso en pacientes adultos sometidos a cirugía de prótesis total de cadera y rodilla.
En agosto de 2011 la EMA (Agencia Europea de Medicamentos) aprobó el uso de Dabigatran para la prevención del ictus y de la embolia sistémica en pacientes con fibrilación auricular no valvular y al menos un factor de riesgo: ictus previo, accidente isquémico transitorio o embolia sistémica; fracción de eyección del ventrículo izquierdo < 40%; insuficiencia cardiaca sintomática clase II o más de la NYHA; edad ≥ 75 años o edad ≥ 65 años asociada a diabetes mellitus, enfermedad coronaria o hipertensión arterial.
Para esta indicación se recomienda una dosis de 150 mg dos veces al día, pero para los pacientes mayores de 80 años, los que presenten mayor riesgo de hemorragia y los que reciban tratamiento concomitante con verapamilo, se aconseja administrar 110 mg dos veces al día.
RIVAROXABAN
Es un inhibidor directo y selectivo del factor Xa.
Se administra vía oral en dosis de 10 mg al día, iniciándose el tratamiento 6-8 horas después de la intervención quirúrgica. No se recomienda su uso concomitante con antimicóticos azólicos e inhibidores de la proteasa del VIH.
Tras los resultados de los estudios RECORD (I, II, II y IV) se aprobó su uso para la prevención del tromboembolismo venoso en pacientes adultos en cirugía de prótesis total de cadera y rodilla. En los cuatro estudios se observó una reducción de la incidencia de TEV con la administración de 10 mg al día de Rivaroxaban frente a Enoxaparina 40 mg, sin un aumento significativo del riesgo hemorrágico.
Se están llevando a cabo diversos estudios para determinar la eficacia y seguridad de Rivaroxaban en el tratamiento y prevención secundaria de la enfermedad tromboembólica venosa en comparación con Enoxaparina (programa EINSTEIN), en la prevención del ictus frente a Warfarina (estudio ROCKET-FA) y en la prevención de la ETV en pacientes médicos críticos (estudio MAGELAN).
RECOMENDACIONES PARA LA REALIZACIÓN DE TÉCNICAS DE ANESTESIA REGIONAL
Dabigatran
Se puede realizar una anestesia subaracnoidea de punción única administrando Dabigatran según el protocolo habitual (1-4 horas tras el final de la cirugía).
En el caso de anestesia epidural con catéter se desaconseja el uso de Dabigatran, ya que su vida media larga (entre 17 y 19 horas) no permite la retirada segura del catéter. Algunos autores recomiendan el uso de HBPM inicialmente hasta la retirada del catéter y administrar Dabigatran posteriormente (la primera dosis por lo menos 2 horas después de retirar el catéter).
Rivaroxaban
Se recomienda retirar el catéter epidural por lo menos 18 horas después de la última dosis de Rivaroxaban y la siguiente dosis se debe administrar por lo menos 6 horas después.
En el caso de realizar una anestesia intradural se administrará Rivaroxaban a las 6-8 horas del final de la cirugía.
BIBLIOGRAFÍA
Spahn DR, Korte W. Novel Oral Anticoagulants: New Challenges for Anesthesiologists in Bleeding Patients. Anesthesiology 2012; 116:9 –11.
Levy JH, Key NS, Azran MS: Novel oral anticoagulants: Implications in the perioperative setting. Anesthesiology 2010;113:726 – 45.
Llau Pitarch JV, Ferrandis Comes R, Pastor Martínez E. Nuevos anticoagulantes: Dabigatran y Rivaroxaban. Capítulo 21. Hemostasia, anestesia y cirugía. Ed. Ergon, 2011.
Eriksson BI, Dahl OE, Rosencher N, Kurth AA, Van Dijk CN, Frostick SP. Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism alter total hip replacement: a randomized, double-blind, non-inferiority trial. Lancet 2007;370:949-56.
miércoles, 8 de febrero de 2012
TROMBOELASTOMETRÍA: UNA NUEVA AMIGA QUE NOS AYUDA A MONITORIZAR LA COAGULACIÓN.
Es un test que explora todo el proceso de la coagulación de forma global e integral, desde la hemostasia primaria y la secundaria hasta la fibrinolisis.
2.- Y entonces, ¿qué es el ROTEM?
Es un dispositivo patentado por Pentapharm GMBH Munich que mide tromboelastometría.
3.- ¿En que se basa?
El principio básico consiste en un trazo que se produce al medir los cambios en la elasticidad-viscosidad del coágulo asociados a la polimeración de fibrina
4.- ¿Cómo funciona?
La muestra de sangre se deposita en una cubeta. Un pin cilíndrico sujeto a un eje está inmerso en ella. Los movimientos de rotación entre ellos son detectados y enviados a un ordenador. La coagulación y la lisis producen cambios de torsión que también detecta el ordenador y se reflejan en la gráfica impresa junto a los parámetros numéricos correspondientes.
5.- ¿Qué parámetros mide el ROTEM?
- Tiempo de coagulación (CT): Tiempo desde el comienzo de la medición hasta el inicio del coágulo. Se mide en segundos. Nos da información sobre los factores plasmáticos de la coagulación o la existencia de anticoagulantes circulantes.
- Tiempo de formación del coágulo (CFT): Tiempo desde el inicio del coágulo hasta que se detecta una firmeza de 20 mm. Se mide en segundos y da información sobre factores, anticoagulantes, polimerización de la fibrina y estabilización del coágulo con plaquetas, fibrina y factor XIII.
- Máxima firmeza del coágulo (MCF): Es la máxima amplitud de la curva. Se mide en milímetros. Valora fibrinógeno, plaquetas y factor XIII.
- Lisis máxima (ML): Reducción de la firmeza del coágulo después de la MCF. El coágulo sigue siendo estable si ML<15%. Comienza a producirse fibrinólisis si ML>15%. Se mide a los 30 y a los 60 minutos.
6.- ¿Qué test podemos realizar?
- EXTEM: Test global que analiza la ruta extrínseca, desde la cascada de coagulación hasta la consolidación del coágulo y posterior fibrinólisis. Corresponde al tiempo de protrombina.
- INTEM: Test global que analiza la ruta intrínseca, desde la cascada de coagulación hasta la consolidación del coágulo. Corresponde al tiempo parcial de tromboplastina activada.
- FIBTEM: Monitorización específica del fibrinógeno.
- APTEM: Es similar al EXTEM, pero el reactivo contiene aprotinina que inhibe la fibrinólisis.
- HEPTEM: Es similar al INTEM, pero el reactivo contiene heparinasa y se puede detectar las alteraciones de la coagulación que se deben a heparina-.
7.- ¿Qué ventajas tiene el ROTEM?
- Realizar un tratamiento más rápido, orientado y guiado.
- Ahorro de hemoderivados.
- Mejor cuidado del paciente por menores pérdidas sanguíneas.
- Menor tiempo de estancia hospitalaria.
- Mayor control del consumo de F VII, fibrinógeno, F VIII, XIII
- Monitorizar situaciones de hipercoagulabilidad.
8.- ¿Cuándo se debe utilizar el ROTEM?
- Al inicio de la cirugía
- Si aparece un sangrado llamativo
- Después de cada acción terapéutica con hemoderivados o complejos procoagulantes.
- Al final del procedimiento.
- En el postoperatorio.
Lectura recomendada: A. Pérez Ferrer. Medicina transfusional. Editorial Panamericana. Madrid. 2010.
martes, 7 de febrero de 2012
ESPAÑA Y LA MEDICINA DE MONTAÑA. ANTECEDENTES HISTÓRICOS
Entrada realizada por Manuel Luis Avellanas Chavala , médico intensivista del Hospital San Jorge (Huesca ).
Cuando se hace historia sobre el hombre, la montaña y la medicina, lo habitual es hacer referencia a las penurias que sufrieron los miembros de una escolta que el emperador chino Ching-Te (37-32 a C) envió hacia Afganistán y tuvieron que atravesar montañas de 4.500 m de altitud (1,2).
Gilbert (3) que hizo una publicación sobre estos aventureros chinos, recoge una interesantísima narración de Too Kin, miembro de la expedición, donde se describen los nombres de algunas de las montañas que atravesaron, nombres que reproducen fielmente la sintomatología del mal de altura: “Montaña del Pequeño Mal de Cabeza”, “Montaña del Gran Mal de Cabeza”, “Pendiente de la Fiebre”.
Cinco siglos más tarde, otro chino llamado Fa Hsien narra perfectamente, después de un viaje entre Cachemira y Afganistán, la muerte de un compañero por edema pulmonar, cuando caminaba por un paso a gran altitud: “por la comisura de los labios comenzó a salir una espuma rosácea hasta que dejó de respirar”.
Pero existe un importante hecho histórico que los médicos no relacionados con la medicina de montaña deben conocer, que en muchas publicaciones no se hace referencia, como sucede en un trabajo recientemente publicado (2) y del cual los españoles debemos sentirnos orgullosos.
 La primera descripción precisa del mal de montaña se remonta al tiempo de la conquista española de los Andes y, curiosamente, no fue realizada por los médicos que acompañaban a las tropas, sino por un fraile que fue a cristianizar. El Padre José de Acosta, en su obra “Historia natural y moral de las Indias” (4), publicada en 1.590, narra como fue presa de la angustia, fatiga y de los vómitos al pasar por un collado de 4.800 m de altitud, y adjunta:” Estoy convencido que la textura del aire que es sutil y tierno, no se adapta a la respiración del hombre, el cual necesita un aire más pesado y caliente”.
La primera descripción precisa del mal de montaña se remonta al tiempo de la conquista española de los Andes y, curiosamente, no fue realizada por los médicos que acompañaban a las tropas, sino por un fraile que fue a cristianizar. El Padre José de Acosta, en su obra “Historia natural y moral de las Indias” (4), publicada en 1.590, narra como fue presa de la angustia, fatiga y de los vómitos al pasar por un collado de 4.800 m de altitud, y adjunta:” Estoy convencido que la textura del aire que es sutil y tierno, no se adapta a la respiración del hombre, el cual necesita un aire más pesado y caliente”.
Junto a la omisión mencionada, sucede otra similar cuando se hace historia sobre las guerras y su relación con el mal de altura. Lo habitual, quizá por su mayor proximidad, por la cantidad de publicaciones que originó (5-6) y por los problemas que al ejército indio causó una guerra en altitud, es hacer referencia a la invasión que en 1.964, y a través del Himalaya, China hizo a la India: “Los indios comprendieron que sus tropas estaban en gran desventaja en comparación con los chinos que residían en la altura en la meseta tibetana. Durante el conflicto las tropas indias sufrieron mucho con la enfermedad de altura”(2).
Sin embargo, el primer ejército en sentar las bases de la aclimatación, porque tuvo que enfrentar a sus hombres con la altitud y con los nativos que podían vivir a más de 4.500 m., fue el que envió España a la conquista de América. Pizarro que había conquistado en 1.533 Cuzco se dio cuenta de un hecho crucial. Los hombres más fuertes, aquellos que subían rápidamente de Lima a la antigua capital Inca, sufrían una serie de trastornos que los invalidaban durante uno o dos días, mientras que los más débiles, que debían hacer algún día de reposo durante el camino, llegaban a Cuzco en excelentes condiciones. Consecuentemente con esta observación, Pizarro mandó instalar un campamento a mitad del camino, donde obligatoriamente debían pasar unos días tanto los soldados que ascendían a Cuzco, como los que descendían a Lima (7). Estos antecedentes históricos sirvieron para sentar las bases y fomentar las investigaciones que los médicos montañeros españoles han realizado con la patología de la altitud y, que con el tiempo, también pasarán a formar parte de la historia.
Bibliografía
1.- Richalet JP, Rathat C. Pathologie et altitude. Paris: Masson, 1990; 1-8.
2.- Mellor A. Research at high altitudes. J R Army Med Corps 2011; 157: 5-7.
3.- Gilbert DL. The first documented report of mountain sickness. The China or Headache Mountain Story. Resp Physiol 1983; 52: 315-326.
4.- Acosta (de) J. Historia natural y moral de las Indias. Sevilla 1590. Obras del Padre José de Acosta. Madrid: Atlas, 1954; 2-247.
5. Singh I, Kapila CC, PK Khanna, Nanda RB, Rao BD. High-Altitude Pulmonary
Oedema . Lancet 1965; 30 :229-34.
6. Singh I, PK Khanna, MC Srivastava, Lal M, Roy SB, Subramanyam CS. Acute mountain sickness. N Engl J Med 1969; 280: 175-84.
7.- Castelló-Roca A. Hombre, Montaña y Medicina. Barcelona: Instutut d'Estudis de la Medicina de Muntanya (IEMM), 1993.
Cuando se hace historia sobre el hombre, la montaña y la medicina, lo habitual es hacer referencia a las penurias que sufrieron los miembros de una escolta que el emperador chino Ching-Te (37-32 a C) envió hacia Afganistán y tuvieron que atravesar montañas de 4.500 m de altitud (1,2).
Gilbert (3) que hizo una publicación sobre estos aventureros chinos, recoge una interesantísima narración de Too Kin, miembro de la expedición, donde se describen los nombres de algunas de las montañas que atravesaron, nombres que reproducen fielmente la sintomatología del mal de altura: “Montaña del Pequeño Mal de Cabeza”, “Montaña del Gran Mal de Cabeza”, “Pendiente de la Fiebre”.
Cinco siglos más tarde, otro chino llamado Fa Hsien narra perfectamente, después de un viaje entre Cachemira y Afganistán, la muerte de un compañero por edema pulmonar, cuando caminaba por un paso a gran altitud: “por la comisura de los labios comenzó a salir una espuma rosácea hasta que dejó de respirar”.
Pero existe un importante hecho histórico que los médicos no relacionados con la medicina de montaña deben conocer, que en muchas publicaciones no se hace referencia, como sucede en un trabajo recientemente publicado (2) y del cual los españoles debemos sentirnos orgullosos.
 La primera descripción precisa del mal de montaña se remonta al tiempo de la conquista española de los Andes y, curiosamente, no fue realizada por los médicos que acompañaban a las tropas, sino por un fraile que fue a cristianizar. El Padre José de Acosta, en su obra “Historia natural y moral de las Indias” (4), publicada en 1.590, narra como fue presa de la angustia, fatiga y de los vómitos al pasar por un collado de 4.800 m de altitud, y adjunta:” Estoy convencido que la textura del aire que es sutil y tierno, no se adapta a la respiración del hombre, el cual necesita un aire más pesado y caliente”.
La primera descripción precisa del mal de montaña se remonta al tiempo de la conquista española de los Andes y, curiosamente, no fue realizada por los médicos que acompañaban a las tropas, sino por un fraile que fue a cristianizar. El Padre José de Acosta, en su obra “Historia natural y moral de las Indias” (4), publicada en 1.590, narra como fue presa de la angustia, fatiga y de los vómitos al pasar por un collado de 4.800 m de altitud, y adjunta:” Estoy convencido que la textura del aire que es sutil y tierno, no se adapta a la respiración del hombre, el cual necesita un aire más pesado y caliente”.Junto a la omisión mencionada, sucede otra similar cuando se hace historia sobre las guerras y su relación con el mal de altura. Lo habitual, quizá por su mayor proximidad, por la cantidad de publicaciones que originó (5-6) y por los problemas que al ejército indio causó una guerra en altitud, es hacer referencia a la invasión que en 1.964, y a través del Himalaya, China hizo a la India: “Los indios comprendieron que sus tropas estaban en gran desventaja en comparación con los chinos que residían en la altura en la meseta tibetana. Durante el conflicto las tropas indias sufrieron mucho con la enfermedad de altura”(2).
Sin embargo, el primer ejército en sentar las bases de la aclimatación, porque tuvo que enfrentar a sus hombres con la altitud y con los nativos que podían vivir a más de 4.500 m., fue el que envió España a la conquista de América. Pizarro que había conquistado en 1.533 Cuzco se dio cuenta de un hecho crucial. Los hombres más fuertes, aquellos que subían rápidamente de Lima a la antigua capital Inca, sufrían una serie de trastornos que los invalidaban durante uno o dos días, mientras que los más débiles, que debían hacer algún día de reposo durante el camino, llegaban a Cuzco en excelentes condiciones. Consecuentemente con esta observación, Pizarro mandó instalar un campamento a mitad del camino, donde obligatoriamente debían pasar unos días tanto los soldados que ascendían a Cuzco, como los que descendían a Lima (7). Estos antecedentes históricos sirvieron para sentar las bases y fomentar las investigaciones que los médicos montañeros españoles han realizado con la patología de la altitud y, que con el tiempo, también pasarán a formar parte de la historia.
Bibliografía
1.- Richalet JP, Rathat C. Pathologie et altitude. Paris: Masson, 1990; 1-8.
2.- Mellor A. Research at high altitudes. J R Army Med Corps 2011; 157: 5-7.
3.- Gilbert DL. The first documented report of mountain sickness. The China or Headache Mountain Story. Resp Physiol 1983; 52: 315-326.
4.- Acosta (de) J. Historia natural y moral de las Indias. Sevilla 1590. Obras del Padre José de Acosta. Madrid: Atlas, 1954; 2-247.
5. Singh I, Kapila CC, PK Khanna, Nanda RB, Rao BD. High-Altitude Pulmonary
Oedema . Lancet 1965; 30 :229-34.
6. Singh I, PK Khanna, MC Srivastava, Lal M, Roy SB, Subramanyam CS. Acute mountain sickness. N Engl J Med 1969; 280: 175-84.
7.- Castelló-Roca A. Hombre, Montaña y Medicina. Barcelona: Instutut d'Estudis de la Medicina de Muntanya (IEMM), 1993.
domingo, 5 de febrero de 2012
ACLARAMIENTO DE VERDE INDOCIANINA Y FUNCIÓN HEPÁTICA
Entrada realizada por el Dr . L. Olmedilla.. Hospital Gregorio Marañón de Madrid.
 El verde de indocianina (ICG) es un colorante con cuatro características farmacológicas que le confieren su interés. 1) No se metaboliza, 2) Se elimina por captación pasiva (por gradiente de concentración) pasando de la sangre al interior de los hepatocitos, 3) El hepatocito lo elimina por un proceso activo hacia los canalículos biliares y 4) No sufre recirculación eneterohepática.
El verde de indocianina (ICG) es un colorante con cuatro características farmacológicas que le confieren su interés. 1) No se metaboliza, 2) Se elimina por captación pasiva (por gradiente de concentración) pasando de la sangre al interior de los hepatocitos, 3) El hepatocito lo elimina por un proceso activo hacia los canalículos biliares y 4) No sufre recirculación eneterohepática.
Por ello si después de una inyección intravenosa medimos la concentración en sangre, podremos determinar el aclaramiento del ICG y ese dato nos proporcionará información sobre la circulación hepato-esplácnica y sobre la función de los hepatocitos. Estos conceptos no son novedosos.
Ya en una publicación de 1960 se describían estas propiedades del ICG (Cherrick. Properties, plasma decay and hepatic extraction. J Clin Invest 1960) y se aprobó su empleo como test diagnóstico de la función hepática en la FDA.
La diferencia es que la medida de la concentración en sangre se realizaba por colorimetría en muestras seriadas de sangre y hoy disponemos de un monitor que realiza ese trabajo a pie de enfermo en 10 minutos. Un pulsioxímetro mide el porcentaje de hemoglobina saturada por absorción de luz a 905 nm, y el monitor LIMON (Pulsion Medical Systems) mide la concentración en sangre del ICG de la misma forma, pero emitiendo luz con una longitud de onda de 805 nm.
Con los datos de la curva de concentración de ICG el monitor proporciona dos resultados: la tasa de desaparición en el plasma (PDR) y la retención calculada a los 15 minutos (R15).
Para conseguir estos resultados necesitamos un paciente en el que nos interese estudiar la perfusión hepato-esplácnica o la función hepática, colocarle la pinza-sensor, inyectarle 0,25 a 0,5 mg/Kg de peso de ICG en una vena (periférica o central, no importa) y esperar 10 minutos para tener los datos en la pantalla del monitor. Se puede repetir la medida con un máximo de 10 mg/Kg/día.
Contraindicaciones: alergia conocida al ICG o al iodo (incluido en la preparación).
Efectos secundarios: posibles náuseas, taquicardia, exantema, reacciones anafilactoides (descritos casos aislados de laringoespasmo e hipotensión).
Problemas en la lectura de la concentración: son los mismos que en el caso del pulsioxímetro, es decir que se precisa que la perfusión del tejido donde colocamos el sensor sea suficiente y pulsátil. En pacientes muy hipotensos o con perfusiones de vasoconstrictores a dosis altas el sensor no puede leer adecuadamente e indica que no se realice la inyección.
Precauciones el realizar una medida: como los valores se derivan de la pendiente de caida de concentración del ICG, si infundimos líquidos intravenosos rápidamente durante los minutos en que el monitor está relizando la medida, diluiremos el colorante y el aclaramiento medido será falsamente alto.
Otros datos que interesa recordar: todo lo que modifique el flujo sanguíneo hepatico (FSH) alterará la llegada del colorante al hígado y por lo tanto su aclaramiento. Por ejemplo una medida terapéutica encaminada a mejorar la perfusión (infusión de líquidos, inotrópicos, etc.). Y también la inducción de una anestesia general, la ventilación mecánica, insuflación del neumoperitoneo para una laparoscopia, o la anestesia epidural.
UTILIDAD DE LA MEDIDA DEL ACLARAMIENTO DEL ICG
Las tres principales situaciones en las que puede interesar la medida del PDR son 1) Periodo perioperatorio en las hepatectomías, 2) Pacientes críticos y 3) Trasplante hepático.
1.- Hepatectomía
Para planear esta intervención es esencial valorar si es posible resecar todo la zona tumoral con márgenes suficientes para mejorar el pronóstico oncológico del paciente, pero calculando que quede suficiente tejido sano para minimizar el riesgo de una insuficiencia hepática postoperatoria. Con este fin siempre se emplea la volumetría mediante técnicas radiológicas adompañadas por datos de la función hepática. En numerosas publicaciones se consigue un excelente valor predictivo con la suma de volumetría y eliminación de ICG: Imamura 2005, Poon 2005, Lee 2007, Arizumi 2009, Sugimoto 2009, de Liguori 2009, Nanashima 2011, Zheng 2011.
2.- Pacientes críticos
Es lógico pensar que un dato que valore la perfusión esplácnica y la funcion de los hepatocitos puede resultar útil en la valoración de pacientes críticos. Sakka (Chest 2002) estudió retrospectivamente el valor del PDR obtenido inmediatamente al ingreso de 336 pacientes en una unidad de críticos. Este dato aislado mostró un valor pronóstico similar al de las escalas Apache II o SAPS, permitiendo una categorización del riesgo de mortalidad:
Estos resultados se repiten en una publicación de Inal (J Crit Care 2009), aunque también en un trabajo retrospectivo en 40 pacientes ingresados en UCI por sepsis:
No se han realizado trabajos prospectivos para confirmar estos resultados.
3.- Trasplante hepático
Se ha empleado el aclaramiento de ICG para valorar la función en el donante, pero la utilidad principal es el diagnóstico precoz de una disfunción tras el trasplante. Cuando falla el injerto es esencial detectar que hay un problema muy precozmente para poder aplicar medidas si se trata de un problema corregible (como una trombosis arterial), o pedir rápidamente un nuevo órgano si no hay alternativa. En este tema sí hay trabajos prospectivos:
- Levesque (Liver Transpl 2009), en 72 pacientes recogiendo el PDR en los primeros 5 días tras el trasplante:
Olmedilla ( Liver Transplant 2009), prospectivo en 172 pacientes, en el que un PDR bajo una hora tras la reperfusión del injerto (PDRr60) o en las primeras 24 horas (PDR1) tenían el mejor valor predictivo de una disfunción grave (Grado IV: en la que se solicita un nuevo órgano y si no llega a tiempo el paciente fallece):
sábado, 4 de febrero de 2012
Microtalleres en el Curso de Medicina Perioperatoria
Como hemos comentado en anteriores entradas y en el pdf del curso , este año hemos cambiado los habituales talleres , por " microtalleres " .
La idea de los "microtalleres " integrados en un curso de las carcterísticas de este año , es proporcionar al asistente un conociminento concreto , en un tiempo limitado , y de forma amena .
Los microtalleres se desarrollaran en el espacio de 45 minutos intercharlas tal y como viene reflejado en el pdf . Su duración en ningún caso será superior a los 30 minutos . Nuestra idea , a menos que haya un cambio de última hora del que os informaremos , es que puedas acercarte a cualquiera de ellos sin listas , de tal manera que si quieres puedas pasar por todos .
Utilizaremos para ello la mejor tecnología , desde una sencilla pizarra 8 insuperable ) , hasta ordenadores e ipads .
Como durante todas las charlas hay cafés y refrescos , este periodo intercharlas es ideal para los microtalleres .
No será pesados , serán distendidos , intentando transmitir una idea fuerza que te puedas llevar a casa .
La mayoría de los talleres están realizados por miembros del servicio de Anestesia y Reanimación del Hospital La Princesa , además de los responsables que veréis mencionados participa más gente .Tenemos la suerte de que el microtaller de Microbiología estará presentado por microbiólogas del Hospital de La Princesa , y el dela monitorización de la función hepática por Luis Olmedilla del Hospital Gregorio Marañón.
A continuación os mostramos un panel con el cronograma de los microtalleres durante el curso . Os recordamos que se realizarán en los espacios intercharlas a media mañana o media tarde .
Jueves tarde
Taller de microbiología
taller de antibioticos /casos
taller del Rotem
Taller de trombosis
Taller del Limon
Viernes mañana
Taller de micro
Taller de antibióticos /casos
taller del limón
Taller de fluid challenge
Viernes tarde
Taller de eco /lápiz/bloqueos
Taller de rotem
Taller de fluid challenge
Taller de trombosis
Sábado mañana
taller relajantes
taller eco/lapiz /bloqueos
También os queremos informar que la documentación del curso no se facilitará ni en papel , ni en pendrives .
Nuestra experiencia es que el papel acaba tirado en cualquier esquina antes de llegar a casa ( a menos que sea un libro editado ) , y que el contenido de los pendrive no se mira nunca .
Proporcionaremos el material mediante enlaces en la nube tipo dropbox , sugarsync , o google docs ,accesibles a todo el mundo , o mediante vuestro correo electrónico .
Tener el material a través de la nube os permitirá el acceso a él en cualquier momento sin peligro de pérdida .
A los inscritos os proporcionaremos las presentaciones del curso para las que haya dado permiso los ponentes , y documentación sobre esa presentación y los talleres .
Por documentación interesante de verdad no quedará .
Aprovechamos esta entrada para advertiros sobre algunos cambios en la entrada del 29 de Enero ( cambios en la biografía etc de Concepción Cassinello y Jose Luis Caniego ) .
La idea de los "microtalleres " integrados en un curso de las carcterísticas de este año , es proporcionar al asistente un conociminento concreto , en un tiempo limitado , y de forma amena .
Los microtalleres se desarrollaran en el espacio de 45 minutos intercharlas tal y como viene reflejado en el pdf . Su duración en ningún caso será superior a los 30 minutos . Nuestra idea , a menos que haya un cambio de última hora del que os informaremos , es que puedas acercarte a cualquiera de ellos sin listas , de tal manera que si quieres puedas pasar por todos .
Utilizaremos para ello la mejor tecnología , desde una sencilla pizarra 8 insuperable ) , hasta ordenadores e ipads .
Como durante todas las charlas hay cafés y refrescos , este periodo intercharlas es ideal para los microtalleres .
No será pesados , serán distendidos , intentando transmitir una idea fuerza que te puedas llevar a casa .
La mayoría de los talleres están realizados por miembros del servicio de Anestesia y Reanimación del Hospital La Princesa , además de los responsables que veréis mencionados participa más gente .Tenemos la suerte de que el microtaller de Microbiología estará presentado por microbiólogas del Hospital de La Princesa , y el dela monitorización de la función hepática por Luis Olmedilla del Hospital Gregorio Marañón.
- Fluid Challenge : ¿ A qué paciente debo poner fluidos y por qué ? . Ana Gomez Rice , Raquel Rojas Giraldo .
- Microbiología : aprende a interpretar un antibiograma de verdad en 20 minutos . Teresa Alarcón , Angela So , Marina Spinola .
- Cómo se hace un Rotem ( tromboelastrograma ) explicado sencillo . Ricardo Navarro , Carmen Vallejo , Mar Orts
- Peritonitis secundaria : ¿ Ignoramos lo más sencillo ? . Sheila Santidrián , Nerea de La Puente , Fernando Ramasco.
- El limón : ¿ Cómo predecir y monitorizar la función hepática perioperatoria y la circulación esplácnica ?. Luis Olmedilla . H.U. Gregorio Marañón .
- Trombosis venosa profunda : el asesino silencioso . ¿ Cómo predecir el riesgo perioperatorio , y prevenirla facilmente en los pacientes problemáticos ? . Esperanza Mata , Blanca Aznarez , Jesús Nieves
- Bloqueos del miembro superior con ecografía : aprende a hacerlos con un modelo que serás tú ( sin peligro ni dolor ) . Manolo Muñoz , Cárlos Román , Rafael Morales .
- Relajantes musculares . lo básico en 15 minutos .
A continuación os mostramos un panel con el cronograma de los microtalleres durante el curso . Os recordamos que se realizarán en los espacios intercharlas a media mañana o media tarde .
Jueves tarde
Taller de microbiología
taller de antibioticos /casos
taller del Rotem
Taller de trombosis
Taller del Limon
Viernes mañana
Taller de micro
Taller de antibióticos /casos
taller del limón
Taller de fluid challenge
Viernes tarde
Taller de eco /lápiz/bloqueos
Taller de rotem
Taller de fluid challenge
Taller de trombosis
Sábado mañana
taller relajantes
taller eco/lapiz /bloqueos
También os queremos informar que la documentación del curso no se facilitará ni en papel , ni en pendrives .
Nuestra experiencia es que el papel acaba tirado en cualquier esquina antes de llegar a casa ( a menos que sea un libro editado ) , y que el contenido de los pendrive no se mira nunca .
Proporcionaremos el material mediante enlaces en la nube tipo dropbox , sugarsync , o google docs ,accesibles a todo el mundo , o mediante vuestro correo electrónico .
Tener el material a través de la nube os permitirá el acceso a él en cualquier momento sin peligro de pérdida .
A los inscritos os proporcionaremos las presentaciones del curso para las que haya dado permiso los ponentes , y documentación sobre esa presentación y los talleres .
Por documentación interesante de verdad no quedará .
Aprovechamos esta entrada para advertiros sobre algunos cambios en la entrada del 29 de Enero ( cambios en la biografía etc de Concepción Cassinello y Jose Luis Caniego ) .
jueves, 2 de febrero de 2012
SEPSIS Y SHOCK SÉPTICO
Sheila Santidrián Bernal. Servicio Anestesiología y Reanimación.
Hospital Universitario de La Princesa.
Kumar publicó en 2009 un artículo de revisión en Critical Care acerca de la optimización de la terapéutica antimicrobiana en sepsis y shock séptico. Es un artículo espléndido que trata desde farmacología hasta estrategias terapéuticas pasando por las causas de fallo del tratamiento y el control del foco de infección. En los próximos párrafos os hago un resumen del artículo que no tiene desperdicio.
OPTIMIZACIÓN DE LA TERAPÉUTICA ANTIMICROBIANA EN SEPSIS Y SHOCK SÉPTICO
El shock séptico y la sepsis asociados a fallo multiorgánico son la causa de muerte dominante en las UCIs de los países industrializados. La mortalidad ha ido disminuyendo con los años, sobre todo por la mejora en los cuidados de soporte, pero su incidencia sigue en aumento.
Los pacientes con shock séptico, al igual que los pacientes neutropénicos, tienen unas características especiales que los diferencian del resto de pacientes con una infección, lo que marca diferencias en cuanto a la farmacocinética de los antibióticos:
-Tienen disfunción renal y hepática con mayor frecuencia
-Tienen alta prevalencia de disfunción inmune.
-Tienen predisposición a la infección por microorganismos resistentes.
-Mayor frecuencia de efectos adversos.
El manejo de pacientes críticos requiere tomar decisiones rápidas teniendo pocos datos (no sabemos la inmunidad del paciente, el microorganismo responsable…) y la rapidez con la que instauremos el tratamiento antibiótico va a influir en los resultados en los pacientes con sepsis severa o shock séptico.
USO RACIONAL DE ANTIBIÓTICOS EN SEPSIS
Junto con una resucitación apropiada, el uso óptimo de las terapias antibióticas es el factor crítico para la supervivencia. Hay que tener en cuenta tanto el agente causal como las características del huésped (estado inmunológico, la función de sus órganos, sitio de infección) y la farmacocinética y farmacodinamia de los antibióticos. El tratamiento empírico se basa en:
-Presentación clínica.
-Factores epidemiológicos (flora local, patrones de resistencia, antibioterapia previa)
FARMACOLOGÍA CLÍNICA DE LOS ANTIBIÓTICOS
A pesar de una CMI buena, el tratamiento antibiótico puede fallar, porque no se alcancen concentraciones apropiadas de fármaco en el órgano diana, porque el antibiótico tenga una fuerte unión a proteínas, o porque el fármaco no pueda atravesar la pared bacteriana. Además, los test de laboratorio evalúan la respuesta con una concentración de antibiótico constante, a diferencia de la dosificación intermitente que usamos en clínica, y no distinguen entre muerte bacteriana e inhibición de su crecimiento. Por ello el uso de la CMI como el único factor a tener en cuenta al decidir el tratamiento antibiótico es problemático.
Farmacocinética
El objetivo de la terapia antibiótica es instaurar un fármaco apropiado a una concentración suficiente como para que llegue al órgano diana para matar al microorganismo.
Muchos factores pueden afectar a la actividad local del fármaco. La absorción en el paciente crítico no hay que tenerla en cuenta porque la administración es intravenosa. La distribución se ve afectada principalmente por la superficie corporal y el edema. El volumen extracelular está aumentado en estados de sobrecarga de líquido corporal (cirrosis, fallo renal, insuficiencia cardiaca, sepsis tras resucitación con fluídos, trauma y anasarca), y en estas circunstancias, los niveles séricos de fármacos que primero se distribuyen al espacio extracelular, como los aminoglucósidos, estarán bajos. Unos niveles séricos de proteínas y albúmina bajos pueden incrementar la fracción libre de fármaco con lo que hay que tenerlo en cuenta para la dosificación.
Hay factores locales que determinan la concentración del antibiótico en el sitio de infección. Los abscesos presentan barreras para la efectividad del tratamiento, no tienen buena vascularización y aminoglucósidos y vancomicina son inactivados por el DNA que hay en el pus y por el pH ácido.
Muchos antibióticos son eliminados por filtración glomerular, en cuidados críticos tendremos pacientes con un aclaramiento de creatinina anormal, prolongando la vida media de los antibióticos (estados de shock) o acelerando su eliminación (fase hiperdinámica de la sepsis). Hay que tenerlo en cuenta para la dosificación.
Farmacodinamia
El objetivo del tratamiento antibiótico es conseguir la eficacia máxima con la mínima toxicidad. Para las propiedades farmacodinámicas de los antibióticos es básico saber si son bacteriostáticos o bactericidas.
Es común utilizar varios antibióticos a la vez como tratamiento empírico ya que varios estudios han demostrado la importancia de que este tratamiento sea de amplio espectro y este método previene resistencias. Como ejemplo es frecuente la combinación de betalactámicos con aminoglucósidos, su actividad es sinérgica porque atacan a distintas estructuras de las bacterias. La razón más aceptada para asociar antibióticos es que una cobertura subóptima puede aumentar la mortalidad.
Estrategias de dosificación antibiótica
Los antibióticos bactericidas pueden dividirse en dos grupos según el mecanismo por el que atacan a las bacterias, en concentración dependientes o tiempo dependientes. Estos mecanismos afectan a las estrategias de dosificación. Muchos estudios defienden una única dosis diaria para los aminoglucósidos, ya que tienen efecto post-antibiótico incluso cuando las concentraciones del fármaco son subterapéuticas. Los betalactámicos tienen el otro mecanismo, con lo que suelen dosificarse de forma intermitente o incluso en infusión continua.
Resistencia antibiótica
Las resistencias a muchos antibióticos han llegado a ser un problema en los pacientes críticos. Hay casos de microorganismos resistentes a vancomicina, gram negativos productores de beta lactamasas, que hacen que tengan que tratarse con nuevos antibióticos como linezolid, daptomicina, combinar inhibidores de betalactamasas y carbapenemes…
FALLO DE LA TERAPIA ANTIBIÓTICA
El empeoramiento clínico, la fiebre o la leucocitosis suelen malinterpretarse como signos de que el tratamiento antibiótico está fallando. Cuando se desarrolla sepsis severa, los síntomas progresan independientemente de la erradicación del microorganismo y por la propia enfermedad (pancreatitis, insuficiencia adrenal, fallo hepático) aparece sintomatología parecida a la de infección.
Existen varias causas para que falle el tratamiento antibiótico, dosificación insuficiente, que no sea del espectro apropiado, bajos niveles sanguíneos de antibiótico, mala penetración antibiótica en el lugar infectado (abscesos), neutralización antimicrobiana o antagonismo, (causa rara pero a tener en cuenta si estamos tratando con varios antibióticos a la vez), una bacteria inusual o infección no bacteriana. En el paciente crítico la causa más frecuente son los niveles bajos de antibióticos, ya que tienen incrementado el volumen de distribución.
TERAPIA ANTIBIÓTICA Y CONTROL DEL FOCO
La combinación perfecta para la curación del paciente. Lo resume en los siguientes puntos:
La antibioterapia empírica debería cubrir el 100% de los patógenos sospechosos de infección.
La administración intravenosa de antimicrobianos de amplio espectro debe administrarse inmediatamente (preferiblemente en menos de 30 minutos) desde el diagnóstico clínico de shock séptico.
La terapia antimicrobiana debe iniciarse con la dosificación en el extremo superior del rango terapéutico en todos los pacientes con infección potencialmente mortal.
Para el inicio de la terapia antimicrobiana empírica en el shock séptico es preferible una terapia dirigida a microorganismos multirresistentes.
La terapia empírica antimicrobiana debe ajustarse a un régimen estrecho a las 48-72 horas si el patógeno plausible es identificado o si el paciente clínicamente se estabiliza.
Cuando sea posible debe controlarse el foco pronto en pacientes con sepsis severa, shock séptico y otras infecciones potencialmente mortales.
RESUMEN
Todo paciente con sepsis y shock séptico debe ser evaluado a fondo antes de iniciar el tratamiento antibiótico. Los antibióticos intravenosos deben administrarse lo antes posible y siempre dentro de la primera hora desde el diagnóstico de sepsis y shock séptico. Se deben seleccionar antibióticos de amplio espectro que cubran los patógenos probablemente causantes de la infección.
La terapia antimicrobiana debe ser reevaluada diariamente para una optimización eficaz, prevenir resistencias, evitar toxicidad y minimizar costes. Hay que considerar una terapia combinada contra pseudomona, y en caso de pacientes neutropénicos. La terapia combinada no debe durar más de 3-5 días e ir desescalando. La duración del tratamiento típicamente es de 7-10 días, una duración mayor debe ser aplicada si la respuesta es lenta, si hay un inadecuado control del foco quirúrgico o en caso de deficiencias inmunológicas. Hay que interrumpir la terapia antibiótica en caso de que el shock no sea debido a una infección.
Kumar A.
Crit Care Clin. 2009 Oct;25(4):733-51, viii.Optimizing antimicrobial therapy in sepsis and septic shock.
Suscribirse a:
Entradas (Atom)